¿Qué son?

Los estereoisómeros son compuestos que son imágenes especulares la una de la otra, y no solo eso. No se pueden superponer. El ejemplo más claro para explicar este hecho son nuestras propias manos, si las enfrentamos parece que se miran en un espejo, pero si las intentamos pones una encima de la otra (con la palma mirando hacia el mismo lado no seáis tramposos) no se pueden pones una encima de la otra.
Esto es debido al concepto de "quiralidad". Una molécula orgánica es quiral, cuando uno de sus átomos de carbono está unido a 4 cosas distintas.
En química orgánica no solo importa de qué están hechas las moléculas sino también cómo están colocadas. Si bien es verdad que tienen propiedades físicas muy similares (por eso es muy difícil separar ambas especies), las propiedades biológicas son muy diferentes.
La característica que permite diferenciarlas experimentalmente, es que una desvía el plano de la luz polarizada hacia la derecha (los dextrógiros) y sus imágenes en el espejo la desvían hacia la izquierda (levógiros). Se nombran como R y S convencionalmente, no tiene que ver con que el S sea dextrógiro o levógiro, ese es un dato experimental. Cuando hay la misma cantidad de uno que de otro la luz polarizada no se desvía. A esta mezcla se le llama racémico. En la naturaleza la mayoría de las moléculas son dela serie Dextrógira. El por qué está por estudiar aunque existen algunas teoría interesantes.
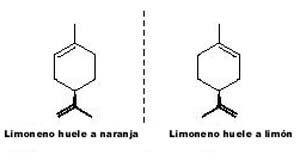
Un ejemplo sensible de esta quiralidad
es la molécula de limoneno. La variente R da el olor a naranja, mientras que a través del espejo, el isómero S aporta el olor a limón. Esto además es una prueba de que nuestros receptores olfativos son quirales: reconocen las disposiciones de las moléculas y envían una señal diferenciable a nuestro cerebro: huele a limón/ huele a naranja.
Implicaciones en farmacéutica: la Talidomida.
Como ya os he comentado su comportamiento biológico es distinto, pues en nuestro cuerpo, las enzimas son quirales. Volvemos a las manos: igual que el guante de cuero derecho no te ajusta bien en la mano izquierda (pongo de cuero porque son los que tienen una forma para cada mano), una enzima especializada para reconocer un isómero S, no encajará bien en un R.
La mayoría de los medicamentos son quirales, no es muy complicado con la gran variedad de combinaciones que hay en las moléculas orgánicas que un carbono esté sustituido por 4 cosas distintas. Y ya sabéis eso de que lo que no mata engorda, ¡pero no es lo mismo morirse que coger unos kilos! Por eso es necesario en farmacia seleccionar el isómero que tiene el efecto deseado, ya que el opuesto puede tener efectos muy diferentes. Pero su separación es difícil y costosa.

Un caso bastante trágico es el de la Talidomida. Un medicamento que se comercializó alrededor de los años 60' como racémico y que era prescrito para hacer desaparecer náuseas y vómitos en embarazadas. Este era el efecto de uno de sus isómeros, a través del espejo era teratogénico, y provocada malformaciones en el feto como las indicadas en la foto: manos y pies muy cortitas. El producto como es lógico se retiró (los más tardíos los españoles como no...) y aún quedan damnificados. Ahora ya no está permitido comercializar los medicamentos como racémicos, se siguen protocolos bastante estrictos aunque la actuación de ambos isómeros sea muy similar.
Hay más ejemplos como el Darvon y el Novrad (hay que reconocer que la elección de los nombres es original para ser estereisómeros). Mientras el Darvon en un analgésico el Novrad actúa como antitusivo.
El caso de la epinefrina sintética es parecido, mientras el isómero R (que coindice con la natural)tiene el propio efecto estimulante, la variente S que se obtiene sintéticamente es ligeramente tóxica.
Ahora cuando os miréis al espejo espero que os preguntéis como sois al otro lado cuando no os estáis viendo.
No hay comentarios:
Publicar un comentario